许多生理和病理过程都伴随着pH值变化✋👨🏽🍼。例如,正常细胞溶酶体和吞噬体的pH在5.0‒6.0左右,癌细胞葡萄糖代谢途径由氧化磷酸化转变为糖酵解(Warburg效应)导致肿瘤细胞外液显著酸化(pH 6.2‒6.9)🛰👉🏻。由于酸化与病理生理过程密切相关🚼,在细胞、组织以及活体不同尺度实现pH可视化对疾病诊疗具有重要意义🧙♂️。
近日🙆🏼♀️🤙🏽,杏悦李聪教授在RSC Advances杂志上发表了题为“Unsymmetrical pentamethine cyanines visualizing physiologic acidities from whole animal to cellular scale with pH-responsive deep-red fluorescence(从动物活体至细胞尺度实现酸性可视化的五甲川花菁深红荧光探针)”的研究论文🫳。该工作提出了“顺序选择性”合成策略,构建了一系列具有不同pKa的pH响应型深红荧光探针(620‒680 nm)ℹ️,有效提高了不对称五甲川花菁的产率⬇️🏜。该类探针能够在细胞尺度通过荧光共聚焦显微镜和流式细胞仪检测到细胞内涵体pH变化💇🏿♀️👩👩👦👦,继而在脂多糖诱导的炎症小鼠模型中检测到炎性组织酸化🧎🏻♀️,并通过切片显微镜成像验证了组织酸化𓀘。
本工作首先合成了6个基于不对称五甲川花菁的荧光分子DR1-6🅱️👩🏿🦰,提出了“顺序选择性”合成策略🦻🏽,使产率有效提高(图1)🎁🈁。所有产物均显示出pH响应的吸收和发射光谱(图2‒3)🕖。
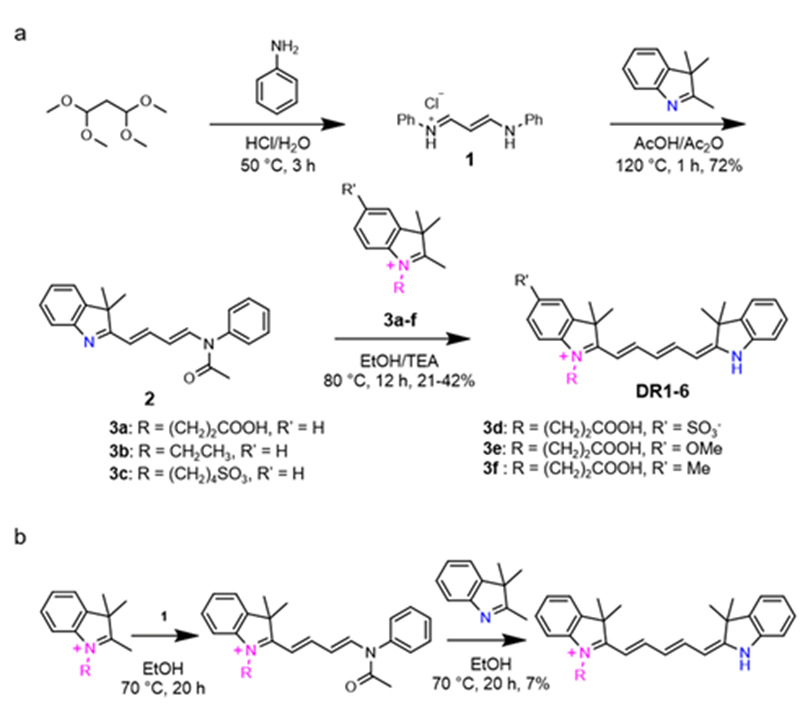
图1. (a) “顺序选择性”策略合成路线。 (b) 反向合成路线导致低产率
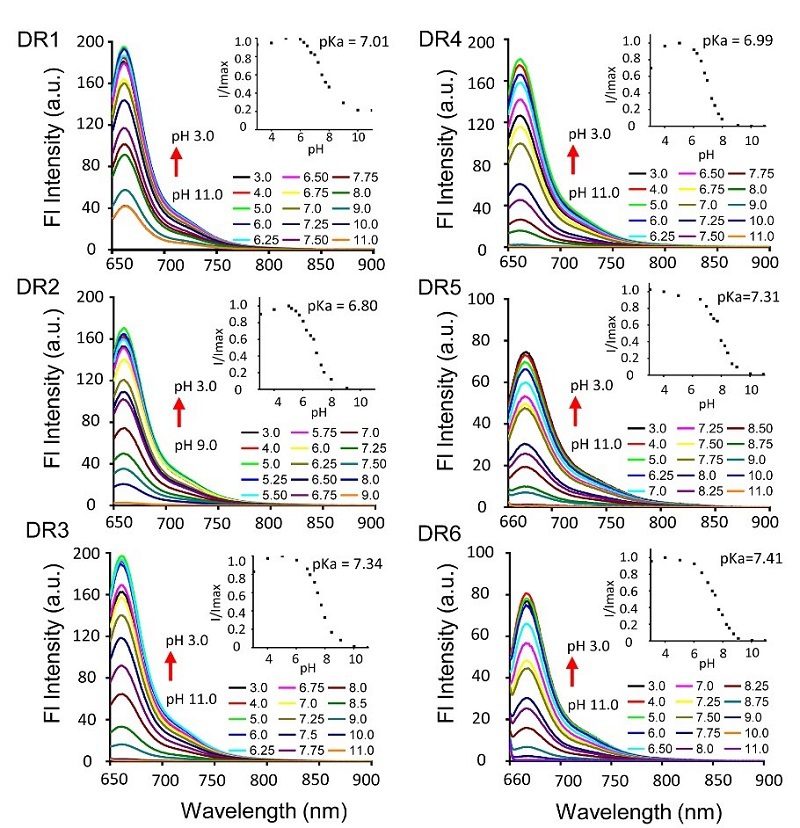
图2.DR1‒6在不同pH下的吸收光谱(2×10-5 M)
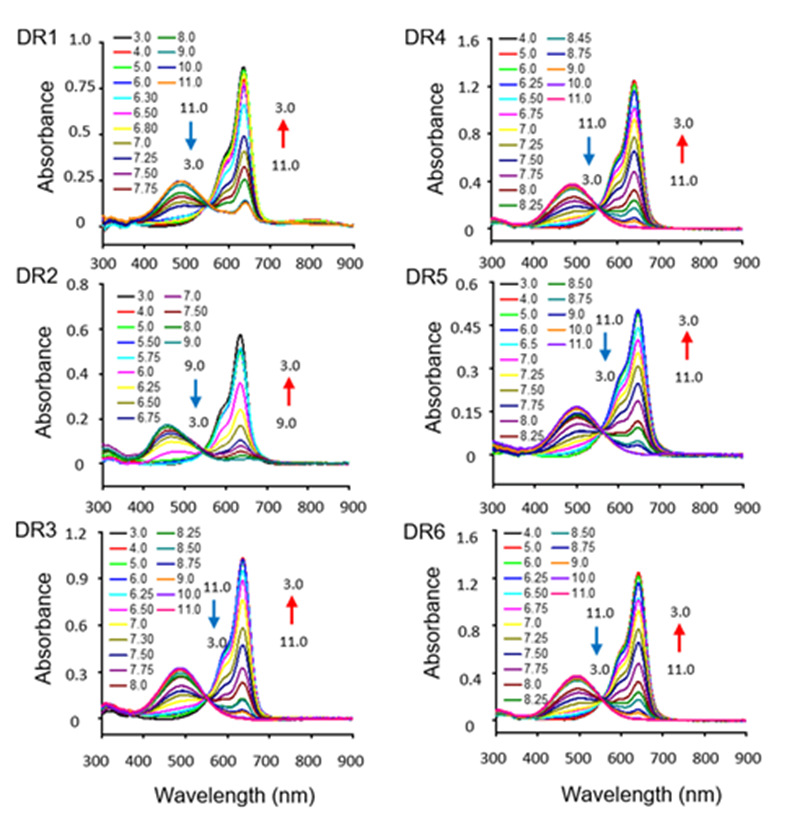
图3.DR1‒6在不同pH下的发射光谱(1×10-6 M)
通过TDDFT轨道计算策略(图4)确认了基于不对称五甲川花菁结构DR1-6荧光探针的pH响应机制🙎🏽♀️。
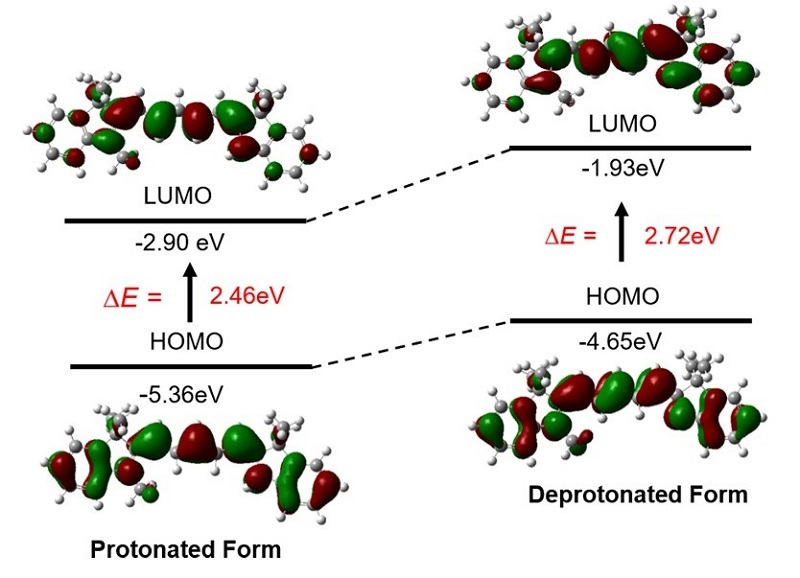
图4.质子化与非质子化条件下的量子化学理论计算
选择荧光量子产率最高的化合物DR1用于细胞和活体成像实验。活细胞荧光共聚焦显微镜成像显示,随着pH降低DR1荧光强度逐渐升高(图5a)🪀👂🏻。流式细胞实验发现在pH 5.0‒8.0范围内👊♔,荧光强度与pH呈线性关系(图5b‒c),验证了DR1可以用于活细胞尺度的pH测定🏂🏻。
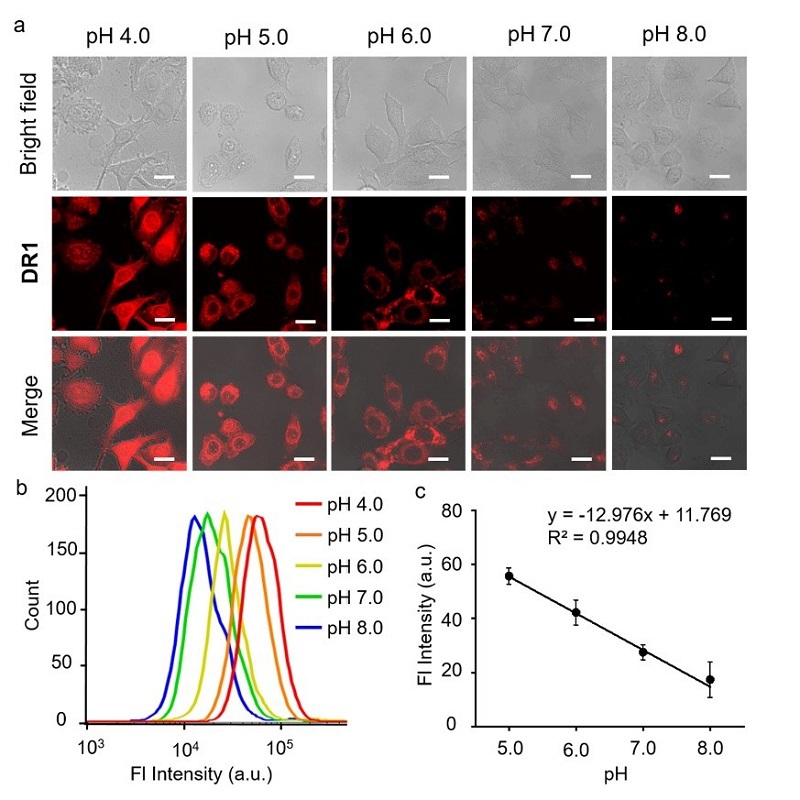
图5.(a) 在不同pH下DR1在Hela细胞内的明场、荧光与叠加图像 (Ex: 633 nm)🌛。
(b)不同pH下经DR1孵育Hela细胞流式数据🦠✝️。(c) 细胞荧光强度与pH值的线性关系🙅🏿♀️,n = 3
最后,采用脂多糖腹腔注射建立小鼠腹部炎症模型。将模型小鼠随机分为两组,一组只注射脂多糖(LPS),另一组组注射脂多糖4小时后腹腔注射探针DR1 (Saline + DR1)🙋🏽♀️。另外一组是健康小鼠腹腔注射生理盐水4小时后腹腔注射DR1 (LPS + DR1)。小动物活体成像仪发现注射DR1 15、30分钟后,实验组的腹部荧光强度远大于对照组(图6 a‒b)。荧光显微镜观察到实验组小鼠的腹膜和肠道组织切片荧光强度也大于阳性对照组(图6c‒d)。另外,pH计测量实验组小鼠腹腔液的pH值在6.60左右,而正常小鼠在7.4左右(图6e)🗞。上述结果证明了探针DR1可以在活体动物和组织切片不同尺度可视化酸化区域🐀🧕🏽。
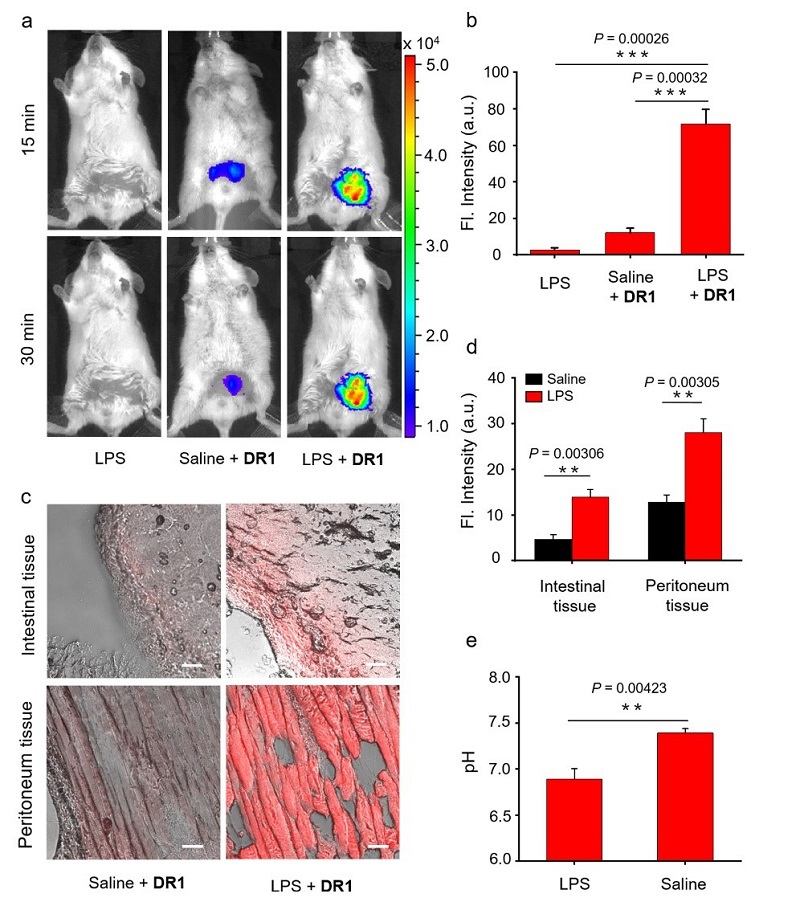
图6. (a) 小鼠分别注射LPS, 生理盐水+DR1与LPS+DR1的活体荧光图片(Ex: 640 nm, Em: 680‒700 nm)。
(b) 腹部平均荧光强度 (n = 3)。(c) LPS、生理盐水+DR1与LPS+DR1组的腹部🥏、肠部组织切片(Ex = 633 nm)🧎🏻♂️➡️。(d) 组织切片的平均荧光强度 (n = 3)。(e) pH计策略腹腔液pH值 (n = 3)🧕🏻。
本工作提出了“顺序选择性”合成策略🦓,提高了不对称五甲川花菁结构荧光基团的产率🥙。由于上述pH响应深红荧光基团可以被633 nm激光有效激发,实现了从活体动物到组织切片到单个细胞等不同尺度的pH成像,为跨尺度研究病理、生理因素导致组织酸化提供了新工具。
杏悦博士研究生王艺澄与杏悦青年研究员雷祖海为该论文的共同第一作者👱。该研究获得了国家自然基金委,上海市科学技术委员会等项目支持🧑🏼🍼。
论文链接https://pubs.rsc.org/en/content/articlelanding/2021/ra/d1ra02217b